بعدما تعرفنا على أن الذرة هي أصغر جزء من مادة ما ،ننتقل إلى دراسة مكونات الذرة
رغم أن الذرة صغيرة جدا ،إلا أنها تتكون من دقائق أصغر منها ،وهذه الدقائق هي النواة والإلكترونات
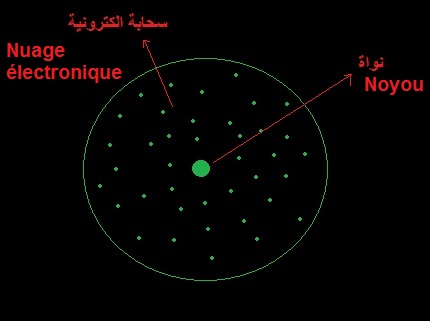

تمثل هذه الصورة نموذجا للذرة
توجد النواة في المركز وتتحرك حولها الإلكترونات التي تشكل سحابة تسمى السحابة الإلكترونية
الإلكترونات
- كل الكترونات الذرات متشابهة فيما بينها
-يرمز للإلكترون كالتالي
توجد النواة في المركز وتتحرك حولها الإلكترونات التي تشكل سحابة تسمى السحابة الإلكترونية
الإلكترونات
- كل الكترونات الذرات متشابهة فيما بينها
-يرمز للإلكترون كالتالي
e-
رمز الإلكترون
symbole de l'électron
رمز الإلكترون
symbole de l'électron
يحمل كل الكترون شحنة كهربائية سالبة ،ورمزها-
-e
e = 1,6 . 10-19 C
وحدة الشحنة الكهربائية هي الكولوم
coulomb:C
e = 1,6 . 10-19 C
وحدة الشحنة الكهربائية هي الكولوم
coulomb:C
النواة
على عكس الإلكترونات ،تحمل النواة شحنات كهربائية موجبة
على عكس الإلكترونات ،تحمل النواة شحنات كهربائية موجبة
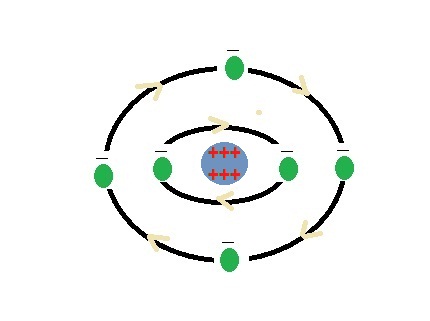
تمثل هذه الصورة نموذجا لذرة الكربون
لاحظ أن عدد الشحنات السالبة التي تحملها الإلكترونات يساوي عدد الشحنات الموجبة التي تحملها النواة
العدد الذري
هناك أنواع مختلفة من الذرات التي تدخل في تركيب المواد مثل ذرات الهيدروجين وذرات الكربون وذرات الأوكسجين وذرات الحديد وذرات الألومنيوم...الخ
يتميز كل نوع من الذرات بعدد الإلكترونات المكون للذرة،ويسمى العدد الذري،ويرمز إليه بحرف
Z
رمز العدد الذري
symbole du numéro atomique
يتميز كل نوع من الذرات بعدد الإلكترونات المكون للذرة،ويسمى العدد الذري،ويرمز إليه بحرف
Z
رمز العدد الذري
symbole du numéro atomique
الذرة متعادلة كهربائيا أي أن مجموع الشحنات الكهربائية لإلكترونات الذرة تعادل الشحنة الكهربائية للنواة.
بما أن الشحنة الكهربائية للإلكترون تساوي
-e
فإن مجموع الشحنات الكهربائية لإلكترونات الذرة هي
q=Z .(-e)=-Ze
بما أن الذرة متعادلة كهربائيا،فإن الشحنة الكهربائية التي تحملها النواة هي
q'=+Ze
لاحظ أن
q+q'=0
هذا يعني أن الشحنة الكربائية الإجمالية للذرة منعدمة
q+q'=0
هذا يعني أن الشحنة الكربائية الإجمالية للذرة منعدمة
يلخص الجدول التالي بعض أنواع الذرات ومكوناتها
| الشحنة الكهربائية للنواة | الشحنة الكهربائية للإلكترونات | العدد الذري | رمزها | اسم الذرة |
| +e | -e | Z=1 | H | هيدروجين |
| +6e | -6e | Z=6 | C | كربون |
| +7e | -7e | Z=7 | N | ازوت |
| +8e | -8e | Z=8 | O | أوكسجين |
| +17e | -17e | Z=17 | Cl | كلور |
| +13e | -13e | Z=13 | Al | ألومنيوم |
| +26e | -26e | Z=26 | Fe | حديد |
| +29e | -29e | Z=29 | Cu | نحاس |
| +30e | -30e | Z=30 | Zn | زنك |
>>
